티스토리 뷰
목차
앙투안 로랑 드 라부아지에는 프랑스의 화학자로 현대 화학의 아버지로 불립니다. 그는 질량 보존의 법칙 확립, 연소 이론 개선, 화학 물질의 체계적 명명법 도입 등의 업적이 있습니다. 그러나 프랑스 혁명기에 세금 징수업자의 역할로 인해 길로틴에 처형되었습니다.


라부아지에의 격동적인 삶
앙투앙 라부아지에는 1743년 파리에서 태어나 현대 화학을 정량 화학으로 발전시키고 연소 이론과 화학 원소 분류에 공헌한 과학자로 인정받고 있습니다. 18세인 1761년에 라부아지에는 법학을 공부하기 시작했지만 자연 과학에 더 큰 관심을 보였으며 25세에 프랑스 과학 아카데미 회원이 되었습니다. 29세에는 연소 과정에서 산소가 소비되며 무게가 변하지 않는다는 것을 실험으로 입증하여 연소의 본질을 알아냈습니다. 32세인 1775년에는 프랑스 정부의 군수물자 관리 책임자가 되어 화약 제조를 개선하였습니다. 40세인 1783년에는 수소와 산소가 결합하여 물을 형성한다는 사실을 처음으로 알아냈습니다.
그러나 1789년 프랑스 혁명으로 51세인 1794년에 반혁명 활동과 공공 기금 횡령 혐의로 체포되어 단두대에서 처형되었습니다. 세금 징수업자로서 재정적으로 안정된 생활을 영위할 수 있었으나 프랑스 혁명기에 그를 위험에 빠뜨렸습니다. 그는 공공 기금 횡령, 국가에 대한 배신, 그리고 혁명 이념에 반하는 활동을 했다는 죄목으로 기소되었습니다. 재판은 매우 빠르게 진행되어서 그에게 충분한 변호의 기회가 주어지지 않았고, 형식적인 재판 과정이었으며 사형이 확정된 상태였습니다. 그의 사형 선고를 보았던 과학자의 발언이 있습니다. "한 순간에 머리를 자를 수 있지만, 그가 만든 지식을 다시 얻기 위해서는 세월이 걸릴 것입니다"라고 전합니다. 그는 1794년 단두대에서 처형되었고 이 사건은 과학적 지식과 정치적 상황의 충돌을 상징하는 사건으로 남았습니다.
다음은 라부아지에의 주요 업적을 연도별로 정리하였습니다.
1743 출생: Antoine-Laurent de Lavoisier는 8월 26일 프랑스 파리에서 태어남.
1768 아카데미 프랑세즈 가입: Lavoisier는 프랑스 과학 아카데미에 입회하여 그의 과학적 연구를 시작함.
1772 연소 이론 연구 시작: Lavoisier는 연소 과정에 대한 체계적인 연구를 시작함. 그는 당시 널리 받아들여지던 플로지스톤 이론을 반박하기 위한 실험을 시작함.
1774 산소 발견: Lavoisier는 Joseph Priestley의 연구를 기반으로 산소를 발견하고, 이는 연소 과정에서 중요한 역할을 하는 원소임을 입증함.
1777 플로지스톤 이론 반박: "의 에서 그는 연소 과정에서 플로지스톤이 아닌 산소가 소비됨을 증명함.
1783 물의 구성 발견: Lavoisier는 물이 수소와 산소로 이루어져 있다는 사실을 입증함. 이는 물이 더 이상 기본 원소가 아니라는 것을 의미함(블로그 3).
1787 화학 명명법 정립: Lavoisier는 다른 과학자들과 함께 새로운 화학 명명법을 제안함. 이 명명법은 화합물의 구성 원소를 명확히 나타내는 체계적인 방식임(블로그 3).
1789 질량 보존의 법칙 발표: "Traité Élémentaire de Chimie" (기초 화학 논문)에서 Lavoisier는 질량 보존의 법칙을 체계적으로 설명함. 이는 화학 반응 전후의 총 질량이 변하지 않는다는 법칙임(블로그 3).
1793 세금 징수원으로서의 활동: 프랑스 혁명 중, Lavoisier는 과거 세금 징수원으로서의 활동 때문에 정치적 공격을 받음.
1794 사망: Lavoisier는 5월 8일 프랑스 혁명 중 재판을 받고 단두대에서 처형됨.
주요 발견 및 연대
산소, 수소, 질소를 이해하고 질량 보존의 법칙에 이르기까지 많은 사람들의 협조와 더불어 여러 해에 걸쳐 점진적으로 이루어졌으며, 각 실험과 연구는 그의 이해를 심화시키고 새로운 발표를 가능하게 했습니다. 그는 기존의 실험 결과를 재해석하고, 정밀한 실험과 측정을 통해 새로운 이론을 정립했습니다.
1. 연소 이론 (Combustion Theory)
- 발견 시기: Lavoisier는 1772년에 연소 과정에서 공기의 역할을 연구하기 시작했습니다. 그는 금속을 연소시키면서 플로지스톤 이론을 반박하는 실험을 수행했습니다.
- 발표 시기: 1777년, Lavoisier는 "Mémoire sur la combustion en général" 논문을 통해 연소가 산소와의 화학 반응임을 주장하며 플로지스톤 이론을 반박했습니다.
2. 산소의 발견 (Discovery of Oxygen)
- 발견 시기: Lavoisier는 1774년에 Joseph Priestley와 Carl Wilhelm Scheele의 연구를 바탕으로 산소를 발견했습니다. 그는 이 기체가 연소와 호흡에 필수적임을 알게 되었습니다.
- 발표 시기: 1778년, Lavoisier는 산소가 독립된 원소임을 공식적으로 발표했습니다. 그는 산소를 연소, 호흡, 산화의 주된 요소로 규명했습니다.
3. 질량 보존의 법칙 (Law of Conservation of Mass)
- 발견 시기: Lavoisier는 여러 실험을 통해 화학 반응 전후의 물질의 총 질량이 변하지 않는다는 사실을 확인했습니다. 이 작업은 1770년대 후반에 집중적으로 이루어졌습니다.
- 발표 시기: 1789년, 그는 그의 저서 "Traité Élémentaire de Chimie"에서 질량 보존의 법칙을 명확히 설명했습니다. 이 법칙은 화학 반응에서 물질이 생성되거나 소멸되지 않고, 단지 다른 형태로 변환된다는 것을 의미합니다.
연소 이론
그는 18세기 후반에 연소 과정을 연구하면서 현대 화학의 기초를 다졌습니다. 당시 플로지스톤 이론이 널리 받아들여졌지만, Lavoisier는 이를 반박하기 위해 다양한 실험을 수행했습니다. 그의 연구는 그가 알고 있었던 과학적 지식에 기초하여 진행되었습니다. 라부아지에가 이 목표를 달성하는 데는 수년이 걸렸고 다른 사람들의 상당한 도움이 필요했습니다.
1. 역사적 배경: 플로지스톤 이론(Phlogiston Theory)
17세기와 18세기 동안 널리 받아들여졌던 연소와 산화에 대한 설명입니다. 이 이론은 물질이 연소할 때 "플로지스톤"이라는 가상의 물질이 방출된다고 주장했습니다.

- 개념: 플로지스톤은 무색, 무취, 무형의 물질로 생각되었으며, 모든 가연성 물질 속에 존재한다고 믿어졌습니다. 물질이 연소할 때 플로지스톤이 방출되며, 이로 인해 물질의 질량이 줄어든다고 설명했습니다.
- 재와 연소 후 잔여물: 물질이 연소한 후 남은 재는 플로지스톤을 잃은 순수한 물질로 간주되었습니다. 예를 들어, 목재가 연소하면 플로지스톤을 방출하고 재만 남게 된다고 생각했습니다.
- 연소와 환원: 연소 과정에서는 플로지스톤이 방출되며, 반대로 금속 산화물이 금속으로 환원될 때는 플로지스톤을 흡수한다고 믿어졌습니다. 이는 연소와 환원 반응을 플로지스톤의 이동으로 설명하려는 시도였습니다.
- 플로지스톤 이론의 한계와 대체: 플로지스톤 이론은 여러 실험적 증거와 맞지 않았습니다. 예를 들어, 금속이 연소하면 질량이 증가하는데, 이는 플로지스톤 이론으로 설명할 수 없었습니다. 이러한 문제점들로 인해, Antoine Lavoisier와 같은 과학자들이 새로운 이론을 제안하게 되었습니다.
2. 실험 준비
- 실험 장비: Lavoisier는 다양한 금속(예: 주석, 철)과 산소를 공급할 수 있는 기구를 사용했습니다. 실험에는 정확한 질량 측정을 위한 분석 저울이 포함되었습니다.
- 기체 수집 장치: 연소 중 발생하는 기체를 수집하기 위해 수은 기체 수집 장치(pneumatic trough)를 사용했습니다. 기체의 양을 정확히 측정하기 위해 수은을 사용하여 기체를 이동시키고 저장했습니다.
3. 실험 과정
- 금속의 연소: Lavoisier는 금속을 연소시켜 그 반응을 관찰했습니다. 예를 들어, 그는 주석을 가열하여 산화 주석을 생성하는 실험을 수행했습니다.
- 질량 측정: 연소 전후의 금속의 질량을 정확히 측정했습니다. 그는 연소 후 금속의 질량이 증가함을 발견했으며, 이는 공기 중의 어떤 물질이 금속과 결합한 결과임을 추론했습니다.
- 기체 분석: 연소 과정에서 발생하는 기체를 수집하고 분석했습니다. 그는 기체의 부피와 질량을 정확히 측정하여, 연소 과정에서 공기의 일부가 소비됨을 확인했습니다.
4. 결과 발표
그의 논문 "Mémoire sur la combustion en général"는 연소에 대한 중요한 연구를 담고 있으며, 1777년에 프랑스 과학 아카데미에 제출되었습니다. 이 논문에서 Lavoisier는 플로지스톤 이론을 반박하고, 연소 과정에서 산소의 역할을 설명했습니다.

5. 당시의 이해
Lavoisier는 연소 실험을 통해 산소의 역할을 이해하고, 질량 보존의 법칙을 확립하는 데 중요한 기여를 했습니다. 그의 연구는 플로지스톤 이론을 반박하고, 연소 과정의 화학적 본질을 이해하는 데 큰 영향을 미쳤습니다.
산소의 발견과 질량 보존의 법칙
앙투안 로랑 드 라부아지에는 질량 보존의 법칙을 실험을 통해 입증하였는데, 이는 화학반응에서 반응물의 질량과 생성물의 질량이 동일하다는 원리를 밝혔습니다. 가장 유명한 실험 중 하나는 연소 실험으로, 특히 수은의 산화를 관찰한 실험입니다.
- 이 실험에서 중요한 점은 반응 전후의 총 질량이 일치한다는 것입니다.
- 즉, 수은과 산소의 질량 합이 수은산화물의 질량과 같고, 수은산화물이 분해될 때 다시 원래의 수은과 산소의 질량으로 돌아갑니다.
- 이는 화학반응에서 질량이 보존된다는 라부아지에의 질량 보존 법칙을 증명합니다.
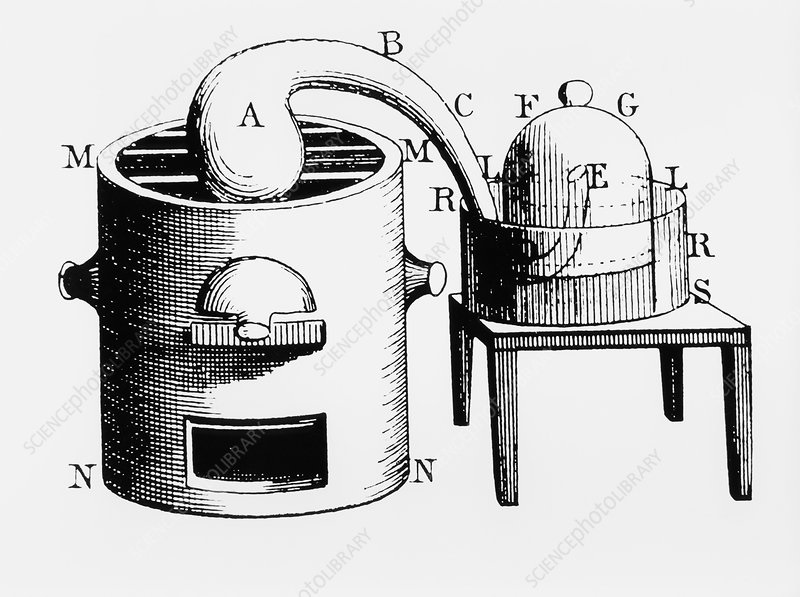
라부아지에가 진행했던 실험을 재현하여 봅니다.
- 위의 그림에서 왼쪽의 레토르트(A)에 수은 113.4 g를 넣고, 그 끝에는 수은 위에 있는 종 항아리(G) 속에 공기를 부피가 819.35 cm3가 되도록 조절한 후 높이 수위(높이 R)를 표시하여 기록하였습니다.
- 레토르트는 12일 동안 부드럽게 가열되는 동안 레토르트 내의 수은 표면에 붉은 반점이 생기기 시작했고 수은은 점차 붉은색을 띠는 금속 가루 형태로 변하였습니다.
- 반응이 끝나고 레토르트를 냉각시켜 상온에서 종 항아리의 공기 부피를 측정한 결과 131.097 cm3로 감소하였습니다(높이 L). 무게는 0.23g이 줄어들었습니다.
- 종 항아리에 남은 가스는 불꽃을 꺼뜨렸습니다. 이것은 공기에서 산소가 제거되었음을 보여줍니다.
- 그 대신 산화 수은의 무게가 0.23g이 증가하였습니다. 줄어든 공기의 무게만큼 산화수은의 무게가 증가한 것입니다.
현대적인 실험식은 다음과 같습니다.
먼저 수은(Hg)을 가열할 때, 공기 중의 산소(O2
- 2Hg + O2 → (300°C 가열) → 2HgO
이 번에는 반대방향으로 진행되는 실험을 수행하기 위해 산화수은 가루를 레토르트에 넣고 높은 온도로 수일 동안 같은 방식으로 가열했습니다. 레토르트 내에서 회색 가스가 발생하며 벽면에 수은 방울이 맺히기 시작하였습니다. 산화 수은 가루에서 수은으로 변하는 반응의 진행이 끝났을 때 무게는 0.23g이 줄었고 내부 공기는 다시 819.35 cm3 증가하였습니다. 산화수은이 수은으로 변하면서 산소가 방출되었기 때문입니다. 이 반응을 현대 화학식으로 표현하면 다음과 같습니다. 즉, 수은(II) 산화물(HgO)을 가열하면 다시 수은(Hg)과 산소(O2
- 2HgO → (600°C 가열) → 2Hg + O2
라부아지에는 이러한 실험 결과와 이론을 여러 저서에 기술하였으며, 그중 화학의 기초(Traité élémentaire de chimie, 1789)라는 저서에서 이 법칙을 상세히 설명하였습니다. 이 실험에서 도출된 결과는 몇 가지가 있습니다.
첫째, 수은이 연소할 때 질량의 증가량은 결합하는 산소의 질량과 같았습니다. 동시에 수은가 결합되어 있던 산소는 다시 열분해 하여 산소 기체가 되었습니다. 질량 보존의 법칙이 성립하는 결과입니다.
둘째, 이 실험을 근거로 라부아지에는 플로지스톤설을 부정합니다. 즉, 모든 가연성 물질에 들어있는 입자이며 물질이 연소할 때 플로지스톤이 빠져나가 물질의 질량이 감소하게 된다는 이론을 부정합니다.
이 실험 결과를 근거로 "물질은 생성되거나 소멸되지 않고, 단지 다른 형태로 변할 뿐이다"라는 내용으로 그의 저서 "Traité Élémentaire de Chimie"(1789) 1장의 2부에서 설명하였습니다. 그는 이 책에서 다양한 화학 반응을 통해 질량 보존의 원리를 입증하고, 이를 현대 화학의 기초 원리로 자리잡게 했습니다.

마무리
라부아지에의 업적은 현대 화학의 탄생을 가능하게 했습니다. 그의 질량 보존의 법칙, 체계적인 화학 명명법, 그리고 연소 이론의 혁신은 모두 화학의 기초를 세우는 중요한 발견들이었습니다. 라부아지에는 과학적 방법론을 통해 화학이 정량적이고 실험적인 과학으로 자리잡도록 했으며, 우리는 그의 업적을 통해 화학의 발전과 과학적 탐구의 중요성을 되새길 수 있습니다.
'역사를 만든 인물들' 카테고리의 다른 글
| 나폴레옹: 내 사전에는 불가능이란 없다 2편 (0) | 2024.04.16 |
|---|---|
| 나폴레옹: 나폴레옹 5법전 1편 (0) | 2024.04.16 |
| 제임스 허턴: 현대 지질학의 아버지 (0) | 2024.04.14 |
| 앙리 파브르: 곤충학 거장의 삶과 연구 (0) | 2024.04.14 |
| 칼 폰 린네: 자연을 체계화한 식물학의 아버지 (0) | 2024.04.13 |
